Reševanje enačb kemijskih reakcij povzroča težave precejšnjemu številu srednješolcev, predvsem zaradi široke palete elementov, ki so vanje vključeni, in dvoumnosti njihovih interakcij. Ker pa glavni del tečaja splošne kemije v šoli preučuje interakcijo snovi na podlagi njihovih reakcijskih enačb, morajo učenci nujno zapolniti vrzeli na tem področju in se naučiti reševati kemijske enačbe, da se v prihodnosti izognejo težavam s predmetom.
Enačba kemijske reakcije je simbolni zapis, ki prikazuje medsebojno delujoče kemične elemente, njihovo količinsko razmerje in snovi, ki nastanejo pri interakciji. Te enačbe odražajo bistvo interakcije snovi z vidika atomsko-molekularne ali elektronske interakcije.
- Na samem začetku šolskega tečaja kemije se učijo reševati enačbe, ki temeljijo na konceptu valence elementov periodnega sistema. Na podlagi te poenostavitve razmislimo o rešitvi kemijske enačbe na primeru oksidacije aluminija s kisikom. Aluminij reagira s kisikom in tvori aluminijev oksid. Ob določenih začetnih podatkih bomo sestavili diagram enačbe.
Al + O 2 → AlO
V tem primeru smo zapisali približen diagram kemijske reakcije, ki le delno odraža njeno bistvo. Snovi, ki sodelujejo pri reakciji, so zapisane na levi strani diagrama, rezultat njihove interakcije pa na desni. Poleg tega so kisik in drugi tipični oksidanti običajno zapisani desno od kovin in drugih reducentov na obeh straneh enačbe. Puščica kaže smer reakcije.
- Da ta sestavljena reakcijska shema pridobi popolno obliko in je v skladu z zakonom o ohranjanju mase snovi, je potrebno:
- Na desno stran enačbe postavite indekse za snov, ki izhaja iz interakcije.
- Izravnajte količino elementov, ki sodelujejo v reakciji, s količino nastale snovi v skladu z zakonom o ohranitvi mase snovi.
- Na desno stran enačbe postavite indekse za snov, ki izhaja iz interakcije.
- Začnimo s prekinitvijo indeksov v kemijski formuli končne snovi. Indeksi so nastavljeni glede na valenco kemičnih elementov. Valenca je sposobnost atomov, da tvorijo spojine z drugimi atomi zaradi kombinacije svojih neparnih elektronov, ko nekateri atomi oddajo svoje elektrone, medtem ko jih drugi pritrdijo na zunanjo energijsko raven. Splošno sprejeto je, da je valenca kemičnega elementa določena z njegovo skupino (stolpcem) v periodnem sistemu. Vendar pa je v praksi interakcija kemičnih elementov veliko bolj zapletena in raznolika. Na primer, atom kisika v vseh reakcijah ima valenco Ⅱ, kljub dejstvu, da je v šesti skupini v periodnem sistemu.
- Da bi vam pomagali krmariti po tej raznolikosti, vam ponujamo naslednjega majhnega referenčnega pomočnika, ki vam bo pomagal določiti valenco kemijskega elementa. Izberite element, ki vas zanima, in videli boste možne vrednosti njegove valence. Redke valence za izbrani element so navedene v oklepajih.
- Vrnimo se k našemu primeru. Zapišimo njegovo valenco na desni strani reakcijskega diagrama nad vsakim elementom.
Za aluminij Al bo valenca enaka Ⅲ, za molekulo kisika O 2 pa bo valenca enaka Ⅱ. Poiščite najmanjši skupni večkratnik teh števil. Enako bo šest. Najmanjši skupni večkratnik delimo z valenco posameznega elementa in dobimo indekse. Za aluminij delite šest z valenco, da dobite indeks 2, za kisik 6/2 = 3. Kemična formula aluminijevega oksida, dobljenega kot rezultat reakcije, bo imela obliko Al 2 O 3.
Al + O 2 → Al 2 O 3
- Po pridobitvi pravilne formule končne snovi je treba preveriti in v večini primerov izenačiti desni in levi del diagrama v skladu z zakonom o ohranitvi mase, saj reakcijski produkti nastanejo iz istih atomov, ki so bile prvotno del izhodnih snovi, ki sodelujejo v reakciji.
- Zakon o ohranitvi mase pravi, da mora biti število atomov, ki so vstopili v reakcijo, enako številu atomov, ki nastanejo pri interakciji. V naši shemi interakcija vključuje en atom aluminija in dva atoma kisika. Kot rezultat reakcije dobimo dva atoma aluminija in tri atome kisika. Očitno je treba diagram izravnati z uporabo koeficientov za elemente in snov, da se upošteva zakon o ohranitvi mase.
- Izravnavo izvedemo tudi tako, da poiščemo najmanjši skupni večkratnik, ki se nahaja med elementi z največjimi indeksi. V našem primeru bo to kisik z indeksom na desni strani enak 3 in na levi strani enak 2. Najmanjši skupni večkratnik bo tudi v tem primeru enak 6. Zdaj najmanjši skupni večkratnik delimo z vrednost največjega indeksa na levi in desni strani enačbe in dobite naslednje indekse za kisik.
Al + 3∙O 2 → 2∙Al 2 O 3
- Sedaj ostane le še izravnavanje aluminija na desni strani. Če želite to narediti, na levo stran postavite koeficient 4.
4∙Al + 3∙O 2 = 2∙Al 2 O 3
- Po razporeditvi koeficientov se enačba kemijske reakcije ujema z zakonom o ohranitvi mase in med njeno levo in desno stran lahko postavimo enačaj. Koeficienti v enačbi označujejo število molekul snovi, ki sodelujejo v reakciji in izhajajo iz nje, ali razmerje teh snovi v molih.
V lekciji 13 "" iz tečaja " Kemija za telebane» razmisli, zakaj so potrebne kemijske enačbe; Naučimo se izenačiti kemijske reakcije s pravilnim razporejanjem koeficientov. Ta lekcija bo od vas zahtevala, da poznate osnove kemije iz prejšnjih lekcij. Ne pozabite prebrati o elementarni analizi za poglobljen pogled na empirične formule in kemijsko analizo.
Kot rezultat reakcije zgorevanja metana CH 4 v kisiku O 2 nastaneta ogljikov dioksid CO 2 in voda H 2 O. To reakcijo lahko opišemo kemijska enačba:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Poskusimo iz kemijske enačbe izluščiti več informacij kot le indikacijo izdelki in reagenti reakcije. Kemijska enačba (1) je NEpopolna in zato ne daje informacij o tem, koliko molekul O 2 se porabi na 1 molekulo CH 4 in koliko molekul CO 2 in H2 O nastane kot rezultat. Če pa pred pripadajočimi molekulskimi formulami zapišemo numerične koeficiente, ki povedo, koliko molekul posamezne vrste sodeluje v reakciji, potem dobimo popolna kemijska enačba reakcije.
Da bi dokončali sestavo kemijske enačbe (1), si morate zapomniti eno preprosto pravilo: leva in desna stran enačbe morata vsebovati enako število atomov vsake vrste, saj med kemijsko reakcijo ne nastajajo novi atomi. ustvarjenih in obstoječih ne uničimo. To pravilo temelji na zakonu o ohranitvi mase, o katerem smo govorili na začetku poglavja.
Potreben je, da iz preproste kemijske enačbe dobimo popolno. Torej, pojdimo k dejanski enačbi reakcije (1): še enkrat poglejmo kemijsko enačbo, točno na atome in molekule na desni in levi strani. Preprosto je videti, da reakcija vključuje tri vrste atomov: ogljik C, vodik H in kisik O. Preštejmo in primerjajmo število atomov vsake vrste na desni in levi strani kemijske enačbe.
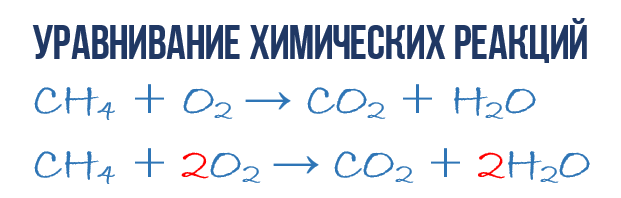
Začnimo z ogljikom. Na levi strani je en atom C del molekule CH 4, na desni strani pa je en atom C del CO 2. Tako je na levi in desni strani število ogljikovih atomov enako, zato ga pustimo pri miru. Toda zaradi jasnosti postavimo koeficient 1 pred molekule z ogljikom, čeprav to ni potrebno:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Nato preidemo na štetje vodikovih atomov H. Na levi strani so 4 atomi H (v kvantitativnem smislu H 4 = 4H) v molekuli CH 4, na desni strani pa le 2 atoma H v molekuli CH 4 . molekule H 2 O, kar je dvakrat manj kot na levi strani kemijske enačbe (2). Izenačimo! Da bi to naredili, dajmo koeficient 2 pred molekulo H 2 O. Zdaj bomo imeli 4 molekule vodika H tako v reaktantih kot v produktih:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Upoštevajte, da koeficient 2, ki smo ga zapisali pred molekulo vode H 2 O, da izenačimo vodik H, poveča za 2-krat vse atome, ki so vključeni v njegovo sestavo, tj. 2H 2 O pomeni 4H in 2O. V redu, zdi se, da smo to uredili, ostane nam le še štetje in primerjava števila atomov kisika O v kemijski enačbi (3). Takoj pade v oči, da je na levi strani točno 2-krat manj atomov O kot na desni. Zdaj že znate sami uravnotežiti kemijske enačbe, zato bom takoj zapisal končni rezultat:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O ali CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Kot lahko vidite, izenačevanje kemijskih reakcij ni tako zapletena stvar in tukaj ni pomembna kemija, ampak matematika. Enačba (4) se imenuje popolna enačba kemijska reakcija, ker upošteva zakon o ohranitvi mase, tj. število atomov vsake vrste, ki vstopijo v reakcijo, natančno sovpada s številom atomov te vrste po zaključku reakcije. Vsaka stran te popolne kemijske enačbe vsebuje 1 atom ogljika, 4 atome vodika in 4 atome kisika. Vendar je vredno razumeti nekaj pomembnih točk: kemijska reakcija je zapleteno zaporedje posameznih vmesnih stopenj, zato na primer enačbe (4) ni mogoče razlagati v smislu, da mora 1 molekula metana hkrati trčiti z 2 kisikovoma molekule. Procesi, ki potekajo med nastajanjem reakcijskih produktov, so veliko bolj zapleteni. Druga točka: popolna enačba reakcije nam ne pove ničesar o njenem molekularnem mehanizmu, torej o zaporedju dogodkov, ki se zgodijo na molekularni ravni med njenim nastankom.
Koeficienti v enačbah kemijske reakcije
Še en jasen primer, kako pravilno urediti kvote v kemijskih reakcijskih enačbah: Trinitrotoluen (TNT) C 7 H 5 N 3 O 6 se močno veže s kisikom in tvori H 2 O, CO 2 in N 2. Zapišimo enačbo reakcije, ki jo bomo izenačili:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Celotno enačbo je lažje sestaviti na podlagi dveh molekul TNT, saj leva stran vsebuje liho število atomov vodika in dušika, desna pa sodo število:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Potem je jasno, da se mora 14 atomov ogljika, 10 atomov vodika in 6 atomov dušika spremeniti v 14 molekul ogljikovega dioksida, 5 molekul vode in 3 molekule dušika:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Zdaj oba dela vsebujeta enako število vseh atomov razen kisika. Od 33 atomov kisika, ki so prisotni na desni strani enačbe, jih 12 dobavljata dve prvotni molekuli TNT, preostalih 21 pa mora dovajati 10,5 molekul O 2 . Tako bo celotna kemijska enačba videti takole:
- 2C 7 H 5 N 3 O 6 + 10,5 O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Obe strani lahko pomnožite z 2 in se znebite koeficienta, ki ni celo število 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Vendar vam tega ni treba narediti, saj ni treba, da so vsi koeficienti enačbe cela števila. Še bolj pravilno bi bilo sestaviti enačbo na podlagi ene molekule TNT:
- C 7 H 5 N 3 O 6 + 5,25 O 2 → 7CO 2 + 2,5 H 2 O + 1,5 N 2 (10)
Celotna kemijska enačba (9) vsebuje veliko informacij. Najprej označuje izhodne snovi - reagenti, in tudi izdelkov reakcije. Poleg tega kaže, da se med reakcijo ohranijo vsi atomi vsake vrste posebej. Če pomnožimo obe strani enačbe (9) z Avogadrovim številom N A = 6,022 10 23, lahko trdimo, da 4 mol TNT reagira z 21 moli O 2 in tvori 28 molov CO 2, 10 molov H 2 O in 6 molov molov N 2.
Obstaja še en trik. S pomočjo periodnega sistema določimo molekulske mase vseh teh snovi:
- C7H5N3O6 = 227,13 g/mol
- O2 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Zdaj bo enačba 9 pokazala tudi, da 4 227,13 g = 908,52 g TNT potrebuje 21 31,999 g = 671,98 g kisika za dokončanje reakcije in kot rezultat 28 nastane 44,010 g = 1232,3 g CO 2, 10·18,015 g = 180,15 g H2O in 6·28,013 g = 168,08 g N2. Preverimo, ali je pri tej reakciji izpolnjen zakon o ohranitvi mase:
| Reagenti | Izdelki | |
| 908,52 g TNT | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Skupaj | 1580,5 g | 1580,5 g |
Ni pa nujno, da posamezne molekule sodelujejo v kemijski reakciji. Na primer, reakcija apnenca CaCO3 in klorovodikove kisline HCl, da nastane vodna raztopina kalcijevega klorida CaCl2 in ogljikovega dioksida CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Kemijska enačba (11) opisuje reakcijo kalcijevega karbonata CaCO 3 (apnenca) in klorovodikove kisline HCl, da nastane vodna raztopina kalcijevega klorida CaCl 2 in ogljikovega dioksida CO 2. Ta enačba je popolna, saj je število atomov vsake vrste na levi in desni strani enako.
Pomen te enačbe je makroskopski (molarni) nivo je naslednji: 1 mol ali 100,09 g CaCO 3 potrebuje 2 mola ali 72,92 g HCl za dokončanje reakcije, kar ima za posledico 1 mol CaCl 2 (110,99 g/mol), CO 2 (44,01 g/mol) in H 2 O (18,02 g/mol). Iz teh numeričnih podatkov je enostavno preveriti, da je pri tej reakciji izpolnjen zakon o ohranitvi mase.
Razlaga enačbe (11) na mikroskopski (molekularni) nivo ni tako očitna, saj je kalcijev karbonat sol, ne molekularna spojina, zato kemijske enačbe (11) ni mogoče razumeti v smislu, da 1 molekula kalcijevega karbonata CaCO 3 reagira z 2 molekulama HCl. Poleg tega molekula HCl v raztopini na splošno disociira (razpade) na ione H + in Cl -. Tako bolj pravilen opis dogajanja v tej reakciji na molekularni ravni poda enačba:
- CaCO 3 (razt.) + 2H + (vod.) → Ca 2+ (vod.) + CO 2 (g.) + H 2 O (l.) (12)
Tu je v oklepajih na kratko označeno fizikalno stanje vsake vrste delcev ( TV- težko, aq.- hidratiran ion v vodni raztopini, G.- plin, in.- tekočina).
Enačba (12) kaže, da trdni CaCO 3 reagira z dvema hidratiranima ionoma H +, pri čemer nastane pozitivni ion Ca 2+, CO 2 in H 2 O. Enačba (12), tako kot druge popolne kemijske enačbe, ne daje pojma o molekularni mehanizem reakcij in je manj primeren za štetje količine snovi, vendar daje boljši opis dogajanja na mikroskopski ravni.
Okrepite svoje znanje o sestavljanju kemijskih enačb tako, da sami obdelate primer z rešitvijo:
Upam, da od lekcije 13" Pisanje kemijskih enačb»Naučil si se nekaj novega zase. Če imate kakršna koli vprašanja, jih napišite v komentarje.
Reakcijska enačba v kemiji je zapis kemijskega procesa z uporabo kemijskih formul in matematičnih simbolov.
Ta zapis je diagram kemijske reakcije. Ko se pojavi znak "=", se to imenuje "enačba". Poskusimo jo rešiti.
Primer analize preprostih reakcij
V kalciju je en atom, saj se koeficient ne splača. Tukaj tudi ni zapisan indeks, kar pomeni ena. Na desni strani enačbe je Ca tudi ena. Ni nam treba delati na kalciju.
Poglejmo naslednji element – kisik. Indeks 2 pomeni, da obstajata 2 kisikova iona. Na desni strani ni indeksov, to je en delec kisika, na levi pa sta 2 delca. kaj delamo Dodatnih indeksov ali popravkov kemijske formule ni mogoče narediti, ker je zapisana pravilno.
Koeficienti so tisto, kar je zapisano pred najmanjšim delom. Imajo pravico do spremembe. Zaradi udobja same formule ne prepisujemo. Na desni strani pomnožimo ena z 2, da dobimo 2 kisikova iona.

Ko smo določili koeficient, smo dobili 2 atoma kalcija. Na levi strani je samo ena. To pomeni, da moramo sedaj dati 2 pred kalcij.

Zdaj pa preverimo rezultat. Če je število atomov elementa enako na obeh straneh, potem lahko postavimo znak "enako".

Še en jasen primer: na levi sta dva vodika, za puščico pa imamo tudi dva vodika.

- Pred puščico sta dva kisika, za puščico pa ni indeksov, kar pomeni, da je en.
- Na levi je več, na desni manj.
- Koeficient 2 postavimo pred vodo.

Celotno formulo smo pomnožili z 2 in zdaj se je količina vodika spremenila. Indeks pomnožimo s koeficientom in dobimo 4. In na levi strani ostaneta dva atoma vodika. In da dobimo 4, moramo vodik pomnožiti z dva.

To je v primeru, ko je element v eni in drugi formuli na isti strani, do puščice.

En žveplov ion na levi in en ion na desni. Dva delca kisika in še dva delca kisika. To pomeni, da so na levi strani 4 kisikovi atomi. Na desni strani so 3 kisikovi atomi. To pomeni, da je na eni strani sodo število atomov, na drugi strani pa liho število. Če liho število pomnožimo dvakrat, dobimo sodo število. Najprej ga spravimo na enakomerno vrednost. Če želite to narediti, pomnožite celotno formulo za puščico z dva. Po množenju dobimo šest kisikovih ionov in tudi 2 atoma žvepla. Na levi strani imamo en mikrodelec žvepla. Zdaj pa ga izenačimo. Enačbe postavimo na levo pred sivo 2.

Poklican.
Kompleksne reakcije
Ta primer je bolj zapleten, ker je elementov snovi več.

To se imenuje reakcija nevtralizacije. Kaj je treba tukaj najprej izenačiti:
- Na levi strani je en atom natrija.
- Na desni strani indeks pravi, da sta 2 natrija.
Zaključek nakazuje, da morate celotno formulo pomnožiti z dva.

Zdaj pa poglejmo, koliko je žvepla. Ena na levi in desni strani. Bodimo pozorni na kisik. Na levi strani imamo 6 atomov kisika. Na drugi strani - 5. Manj na desni, več na levi. Liho število je treba pripeljati do sodega števila. Da bi to naredili, pomnožimo formulo vode z 2, kar pomeni, da iz enega atoma kisika naredimo 2.
Zdaj je na desni strani že 6 atomov kisika. Na levi strani je tudi 6 atomov. Preverimo vodik. Dva atoma vodika in še 2 atoma vodika. Torej bodo na levi strani štirje atomi vodika. In na drugi strani so tudi štirje atomi vodika. Vsi elementi so enakopravni. Postavili smo znak enačaja.

Naslednji primer.

Tukaj je primer zanimiv, ker se pojavijo oklepaji. Pravijo, da če je faktor za oklepajem, potem je vsak element v oklepaju pomnožen z njim. Začeti morate z dušikom, saj ga je manj kot kisika in vodika. Na levi je en dušik, na desni, upoštevajoč oklepaje, pa sta dva.

Na desni sta dva atoma vodika, potrebni pa so štirje. To rešimo tako, da preprosto pomnožimo vodo z dva, kar ima za posledico štiri vodike. Super, vodik izenačen. Ostaja kisik. Pred reakcijo je 8 atomov, po - tudi 8.
Super, vsi elementi so enaki, lahko nastavimo "enako".

Zadnji primer.

Naslednji je barij. Je izenačen, ni se ga treba dotikati. Pred reakcijo sta dva klora, po njej pa samo eden. Kaj je treba narediti? Po reakciji postavite 2 pred klor.

Zaradi pravkar nastavljenega koeficienta smo po reakciji dobili dva natrija, pred reakcijo pa tudi dva. Super, vse ostalo je izenačeno.

Reakcije lahko izravnate tudi z metodo elektronske tehtnice. Ta metoda ima številna pravila, po katerih se lahko izvaja. Naslednji korak je ureditev oksidacijskih stanj vseh elementov v vsaki snovi, da bi razumeli, kje je prišlo do oksidacije in kje redukcije.
Reakcije med različnimi vrstami kemičnih snovi in elementov so eden glavnih predmetov študija v kemiji. Da bi razumeli, kako ustvariti reakcijsko enačbo in jo uporabiti za svoje namene, potrebujete precej globoko razumevanje vseh vzorcev medsebojnega delovanja snovi, pa tudi procesov s kemičnimi reakcijami.
Pisanje enačb
Eden od načinov za izražanje kemijske reakcije je kemijska enačba. Zapisuje formulo izhodne snovi in zmnožek, koeficiente, ki kažejo, koliko molekul ima posamezna snov. Vse znane kemijske reakcije so razdeljene na štiri vrste: substitucija, kombinacija, izmenjava in razgradnja. Med njimi so: redoks, eksogeni, ionski, reverzibilni, ireverzibilni itd.
Več o tem, kako napisati enačbe za kemijske reakcije:
- Treba je določiti ime snovi, ki medsebojno delujejo v reakciji. Zapišemo jih na levo stran naše enačbe. Kot primer razmislite o kemični reakciji, ki je nastala med žveplovo kislino in aluminijem. Na levo postavimo reagente: H2SO4 + Al. Nato zapišemo znak enačaja. V kemiji lahko naletite na znak "puščica", ki kaže v desno, ali dve puščici, usmerjeni v nasprotni smeri, pomenita "reverzibilnost". Rezultat interakcije kovine in kisline sta sol in vodik. Produkte, dobljene po reakciji, zapišite za znakom enačaja, to je na desni. H2SO4+Al= H2+ Al2(SO4)3. Torej, lahko vidimo reakcijsko shemo.
- Če želite sestaviti kemijsko enačbo, morate najti koeficiente. Vrnimo se na prejšnji diagram. Poglejmo njegovo levo stran. Žveplova kislina vsebuje atome vodika, kisika in žvepla v približnem razmerju 2:4:1. Na desni strani so 3 atomi žvepla in 12 atomov kisika v soli. Molekula plina vsebuje dva atoma vodika. Na levi strani je razmerje teh elementov 2:3:12
- Da izenačimo število atomov kisika in žvepla, ki sta v sestavi aluminijevega (III) sulfata, je potrebno dati faktor 3 pred kislino na levi strani enačbe. Zdaj imamo 6 atomov vodika levo stran. Če želite izenačiti število elementov vodika, morate pred vodik na desni strani enačbe postaviti 3.
- Zdaj ostane le še izenačenje količine aluminija. Ker sol vsebuje dva kovinska atoma, postavimo koeficient 2 na levo stran aluminija. Posledično dobimo reakcijsko enačbo za to shemo: 2Al+3H2SO4=Al2(SO4)3+3H2.
Ko boste razumeli osnovna načela, kako sestaviti enačbo za reakcijo kemičnih snovi, v prihodnosti ne bo težko zapisati nobene reakcije, tudi najbolj eksotične s kemijskega vidika.
